


Services de CRO en immunogénicité pour évaluer la sécurité et l’efficacité des médicaments dans les études précliniques
L’immunogénicité est un élément majeur du processus de développement des médicaments. L’étude de l’immunogénicité génère des données sur l’efficacité et la sécurité du comportement du candidat-médicament, ce qui permet de transposer les résultats du laboratoire à la clinique.
Les services d’une CRO experimentée peuvent réalisant des tests d’immunogénicité complets peuvent vous permettre d’accélérer vos programmes de recherche.
Pourquoi les tests d’immunogénicité sont-ils importants ?
L’évaluation du risque d’immunogénicité (IRA) doit être contrôlée tout au long du développement du médicament, depuis l’identification de la cible jusqu’à la phase clinique.

L’immunogénicité fait référence à la capacité des nouveaux produits thérapeutiques à stimuler une réponse immunitaire dans le corps humain ou animal, en particulier le développement d’anticorps anti-médicaments (ADA). En effet, la fraction neutralisante des ADA (NAb) peut affecter l’efficacité du produit et potentiellement menacer la sécurité du patient.
La mesure de l’immunogénicité est cependant un processus complexe…
La mesure des réactions immunitaires indésirables est complexe car elle dépend de nombreux aspects spécifiques au médicament, à la cible, au patient et à la maladie. Les anticorps anti-médicaments (ADA) sont détectés à l’aide de méthodes qualitatives basées sur une approche par étape (c’est-à-dire le dépistage / la confirmation / la caractérisation des ADA) dans des échantillons provenant d’études précliniques (BPL) et d’essais cliniques.
|
Pour cela, il est nécessaire de concevoir:
|
  |
Oncodesign Services, une CRO spécialisée dans les tests d’immunogénicité
Oncodesign Services est une CRO de premier plan spécialisée dans la découverte de médicaments et les services précliniques. Avec plus de 25 ans d’expérience, nous offrons des services de bionanalyses d’échantillons et d’immunogénicité, y compris des plateformes pour le développement de méthodes, le transfert de méthodes, la validation de méthodes et l’analyse d’échantillons.
Notre département d’immunogénicité offre des solutions et des services dans le domaine de l’immunogénicité :
-
Production, purification et caractérisation du contrôle positif ADA
..
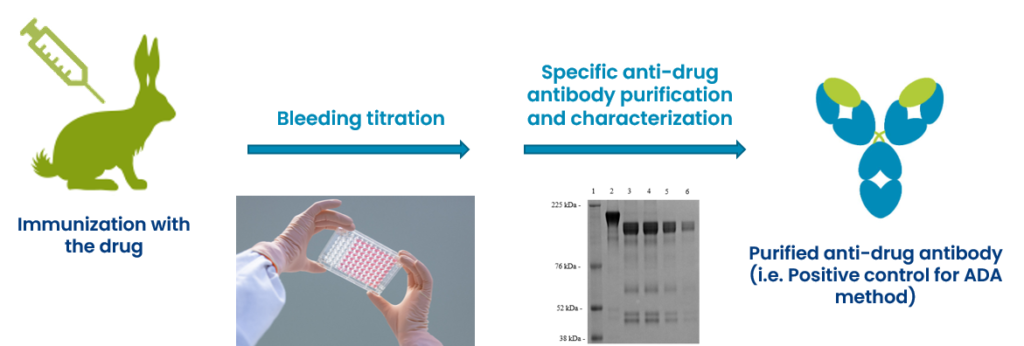
-
Développement de méthodes ADA (pont ECLA sur la technologie Mesoscale Discovery®, ELISA)
- Screening assay / confirmation assay
- Characterization assays :
- Titration assay
- NAb assay (Cell-based assay (CBA), competitive ligand binding assay (CLBA))
- Preparation of specific reagents: Labeled drug (Biotin, ECL-Sulfo-Tag, enzyme, carrier)
- Determination of optimal experimental conditions
- Sample pre-treatment step : dissociation of complexes “drug/ADA” and/or drug extraction to improve drug tolerance of the method
-
Validation de la méthode ADA
It follows current international guidelines (FDA1, EMA2) and white papers from industry (EBF3, EIP4, AAPS5), and according to IRA of the drug, and of the stage of the drug development (preclinic, clinic)
Critical parameters to be determined:
- Minimum Required Dilution (MRD)
- Sensitivity
- Drug tolerance
-
Analyse d'échantillons d'ADA provenant d'études précliniques (BPL) et d'essais cliniques
See the case study below

Plateforme MSD® à Oncodesign Services
Étude de cas – Analyse d’un échantillon d’ADA provenant d’une étude préclinique
Détection d’anticorps anti-médicament « X » dans des échantillons provenant d’une étude de toxicité chez le singe cynomolgus, y compris la récupération et la toxicocinétique.
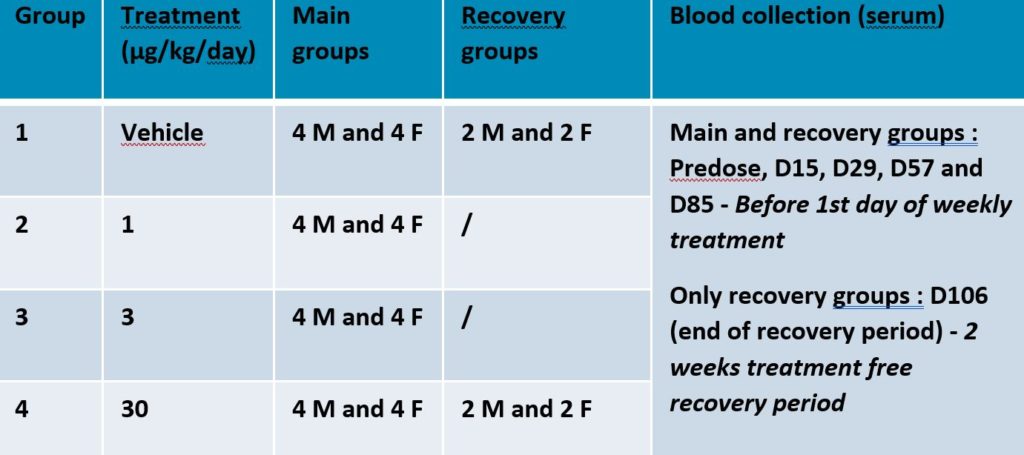
Vocabulaire :
|
Detection de méthode ADA :
|
Results :
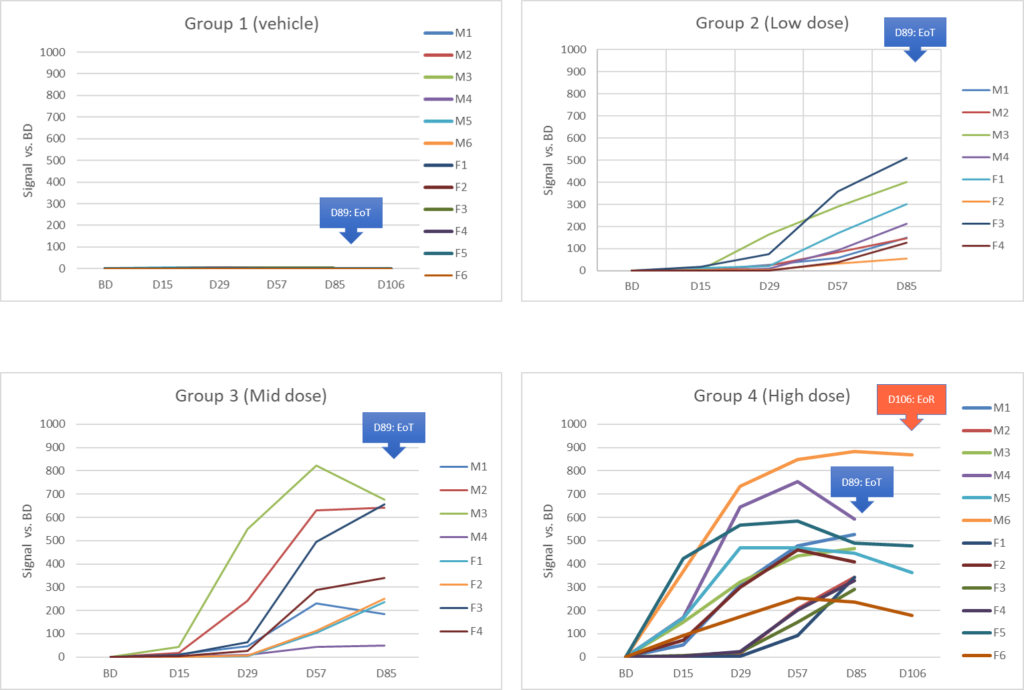
Références :
1.FDA
- S. Food and Drug Administration: Center for Drug Evaluation and Research, Center for Biologics Evaluation and Research. Guidance for Industry: Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection (January 2019).
2. EMEA
- 18 May 2017 EMEA/CHMP/BMWP/14327/2006 Rev 1, Guideline on Immunogenicity assessment of therapeutic proteins.
3. EBF
- Laurén A. et al. A strategic approach to nonclinical immunogenicity assessment: a recommendation from the European Bioanalysis Forum. White Paper – Bioanalysis (2021)
- Kramer D. Risk Based Approaches to Immunogenicity – EBF Training Day: Practical Aspects of Immunogenicity (2021)
- Dreher I. Towards an EBF Recommendation on NAb – Training Day: Managing the Practical Aspects of Immunogenicity (2021)
4. EIP
- Devanarayan V. Screening & Confirmatory Cut-Points – Brief Overview & Answers to some FAQs. EIP Symposium, Immunogenicity of Biopharmaceuticals (2009)
- Devanarayan V. Practical advice & insights on Immunogenicity cut points and some assay validation parameters. EIP Symposium (2019)
- Kramer D. ADA Testing in Repeated Dose Toxicity Studies – Strategies EIP Symposium (2020)
5. AAPS
- Shankar G. et al. Assessment and Reporting of the Clinical Immunogenicity of Therapeutic Proteins and Peptides—Harmonized Terminology and Tactical Recommendations. AAPS J. (2014)
- Devanarayan V. et al. Recommendations for Systematic Statistical Computation of Immunogenicity Cut Points. AAPS J. (2017)
- Myler H. et al. Meeting Report – Report on the AAPS Immunogenicity Guidance Forum. The AAPS Journal (2019)
- Civoli F. et al. Recommendations for the Development and Validation of Immunogenicity Assays in Support of Biosimilar Programs. AAPS J. (2020)
