


Etudes précliniques pour l’inflammation rénale
Les maladies inflammatoires aiguës et chroniques du rein peuvent être déclenchées par plusieurs causes induisant des lésions tissulaires telles que l’exposition à des toxines, des maladies auto-immunes ou des infections. Les modèles d’inflammation et de lésion rénale reposant sur des rongeurs permettent de déchiffrer les mécanismes qui déclenchent et entretiennent la maladie chez les patients.
Oncodesign Services propose une large gamme de modèles précliniques utilisables pour diverses pathologies rénales, et offre le développement de nouveaux modèles d’inflammation rénale récemment décrits dans la littérature.
Critères d’évaluation des modèles d’inflammation rénale
- Score clinique
- Poids corporel
- Examen histopathologique
- Surveillance de biomarqueurs/médicaments
- Expression génique dans les reins, par PCR quantitative/génétique
Liste des modèles d’inflammation rénale
Oncodesign Services propose des modèles d’inflammation rénale tels que :
- Modèle murin de lésion rénale aiguë induite par le cisplatine
- Modèle de néphropathie diabétique chez des souris BTBR ob/ob
- Modèle de fibrose rénale chez le rat, induite par une obstruction urétérale unilatérale
Etude de cas pour les inflammations rénales
Insuffisance rénale aiguë induite par le cisplatine
Si le cisplatine induit de multiples formes de toxicité, notamment une gastrotoxicité, une myélosuppression, une ototoxicité et des réactions allergiques, le principal effet secondaire limitant la posologie est la néphrotoxicité.
On estime que 20 % des patients recevant une dose élevée de cisplatine développent un dysfonctionnement rénal sévère et qu’environ un tiers des patients présentent une atteinte rénale quelques jours seulement après le premier traitement.
Généralement, la créatinine sérique et l’urée augmentent dans les 3 jours suivant le traitement par cisplatine. La nécrostatine (inhibiteur de la RIPK-1) atténue le dysfonctionnement rénal induit par le cisplatine.
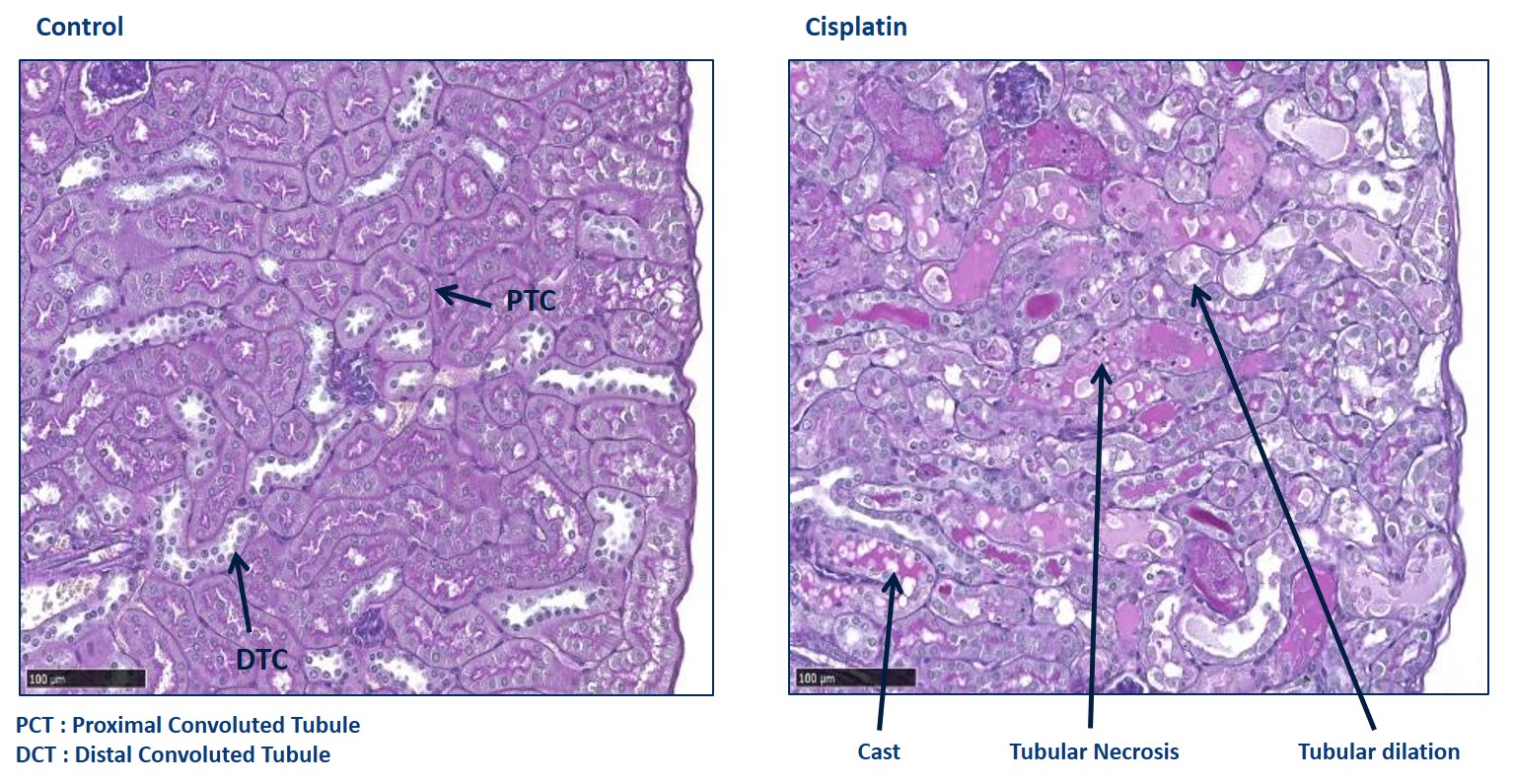
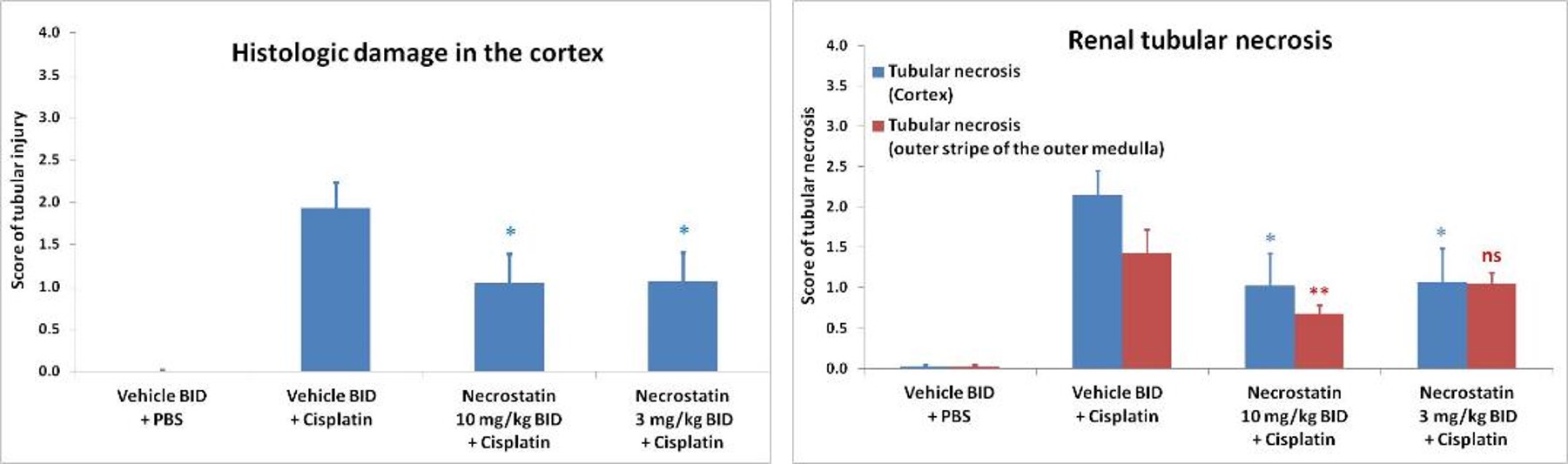
-
Références
(1) Acute kidney injury model in mice, induced by Cisplatin
Luan Z, Wei Y, Huo X, Sun X, Zhang C, Ming W, Luo Z, Du C, Li Y, Xu H, Lu H, Zheng F, Guan Y, Zhang X. Pregnane X receptor (PXR) protects against cisplatin-induced acute kidney injury in mice. Biochim Biophys Acta Mol Basis Dis. 2021 Mar 1;1867(3):165996. doi: 10.1016/j.bbadis.2020.165996. Epub 2020 Oct 27. Erratum in: Biochim Biophys Acta Mol Basis Dis. 2022 Feb 1;1868(2):166305. PMID: 33127475. https://www.sciencedirect.com/science/article/pii/S0925443920303446?via%3Dihub
Chen X, Wei W, Li Y, Huang J, Ci X. Hesperetin relieves cisplatin-induced acute kidney injury by mitigating oxidative stress, inflammation and apoptosis. Chem Biol Interact. 2019 Aug 1;308:269-278. doi: 10.1016/j.cbi.2019.05.040. Epub 2019 May 31. PMID: 31153982. https://www.sciencedirect.com/science/article/abs/pii/S0009279719302819?via%3Dihub
Zhu L, Yuan Y, Yuan L, Li L, Liu F, Liu J, Chen Y, Lu Y, Cheng J. Activation of TFEB-mediated autophagy by trehalose attenuates mitochondrial dysfunction in cisplatin-induced acute kidney injury. Theranostics. 2020 Apr 27;10(13):5829-5844. doi: 10.7150/thno.44051. PMID: 32483422; PMCID: PMC7255003. https://pubmed.ncbi.nlm.nih.gov/32483422/
Lu Q, Wang M, Gui Y, Hou Q, Gu M, Liang Y, Xiao B, Zhao AZ, Dai C. Rheb1 protects against cisplatin-induced tubular cell death and acute kidney injury via maintaining mitochondrial homeostasis. Cell Death Dis. 2020 May 13;11(5):364. doi: 10.1038/s41419-020-2539-4. PMID: 32404875; PMCID: PMC7221100. https://www.nature.com/articles/s41419-020-2539-4
Hamano H, Ikeda Y, Goda M, Fukushima K, Kishi S, Chuma M, Yamashita M, Niimura T, Takechi K, Imanishi M, Zamami Y, Horinouchi Y, Izawa-Ishizawa Y, Miyamoto L, Ishizawa K, Fujino H, Tamaki T, Aihara KI, Tsuchiya K. Diphenhydramine may be a preventive medicine against cisplatin-induced kidney toxicity. Kidney Int. 2021 Apr;99(4):885-899. doi: 10.1016/j.kint.2020.10.041. Epub 2020 Dec 9. PMID: 33307103. : https://www.kidney-international.org/article/S0085-2538(20)31411-3/fulltext
(2) Diabetic nephropathy model in BTBRob/ob mice
- Review:
Alpers CE, Hudkins KL. Mouse models of diabetic nephropathy. Curr Opin Nephrol Hypertens. 2011 May;20(3):278-84. doi: 10.1097/MNH.0b013e3283451901. PMID: 21422926; PMCID: PMC3658822. https://journals.lww.com/co-nephrolhypertens/Abstract/2011/05000/Mouse_models_of_diabetic_nephropathy.12.aspx
- Model characteristics:
Hudkins KL, Pichaiwong W, Wietecha T, Kowalewska J, Banas MC, Spencer MW, Mühlfeld A, Koelling M, Pippin JW, Shankland SJ, Askari B, Rabaglia ME, Keller MP, Attie AD, Alpers CE. BTBR Ob/Ob mutant mice model progressive diabetic nephropathy. J Am Soc Nephrol. 2010 Sep;21(9):1533-42. doi: 10.1681/ASN.2009121290. Epub 2010 Jul 15. PMID: 20634301; PMCID: PMC3013527. https://journals.lww.com/jasn/Abstract/2010/09000/BTBR_Ob_Ob_Mutant_Mice_Model_Progressive_Diabetic.20.aspx
Opazo-Ríos L, Tejera-Muñoz A, Soto Catalan M, Marchant V, Lavoz C, Mas Fontao S, Moreno JA, Fierro Fernandez M, Ramos R, Suarez-Alvarez B, López-Larrea C, Ruiz-Ortega M, Egido J, Rodrigues-Díez RR. Kidney microRNA Expression Pattern in Type 2 Diabetic Nephropathy in BTBR Ob/Ob Mice. Front Pharmacol. 2022 Mar 16;13:778776. doi: 10.3389/fphar.2022.778776. PMID: 35370692; PMCID: PMC8966705. https://www.frontiersin.org/articles/10.3389/fphar.2022.778776/full
Li Y, Hu Q, Li C, Liang K, Xiang Y, Hsiao H, Nguyen TK, Park PK, Egranov SD, Ambati CR, Putluri N, Hawke DH, Han L, Hung MC, Danesh FR, Yang L, Lin C. PTEN-induced partial epithelial-mesenchymal transition drives diabetic kidney disease. J Clin Invest. 2019 Mar 1;129(3):1129-1151. doi: 10.1172/JCI121987. Epub 2019 Feb 11. PMID: 30741721; PMCID: PMC6391108. https://www.jci.org/articles/view/121987
- Testing of compounds:
Sugahara M, Tanaka S, Tanaka T, Saito H, Ishimoto Y, Wakashima T, Ueda M, Fukui K, Shimizu A, Inagi R, Yamauchi T, Kadowaki T, Nangaku M. Prolyl Hydroxylase Domain Inhibitor Protects against Metabolic Disorders and Associated Kidney Disease in Obese Type 2 Diabetic Mice. J Am Soc Nephrol. 2020 Mar;31(3):560-577. doi: 10.1681/ASN.2019060582. Epub 2020 Jan 29. PMID: 31996409; PMCID: PMC7062217. https://journals.lww.com/jasn/Abstract/2020/03000/Prolyl_Hydroxylase_Domain_Inhibitor_Protects.12.aspx
Locatelli M, Zoja C, Conti S, Cerullo D, Corna D, Rottoli D, Zanchi C, Tomasoni S, Remuzzi G, Benigni A. Empagliflozin protects glomerular endothelial cell architecture in experimental diabetes through the VEGF-A/caveolin-1/PV-1 signaling pathway. J Pathol. 2022 Apr;256(4):468-479. doi: 10.1002/path.5862. Epub 2022 Feb 23. PMID: 35000230. https://onlinelibrary.wiley.com/doi/10.1002/path.5862
(3) Kidney fibrosis model in rats, induced by unilateral ureteral obstruction
- Compound efficacy:
Tingskov SJ, Jensen MS, Pedersen CT, de Araujo IBBA, Mutsaers HAM, Nørregaard R. Tamoxifen attenuates renal fibrosis in human kidney slices and rats subjected to unilateral ureteral obstruction. Biomed Pharmacother. 2021 Jan;133:111003. doi: 10.1016/j.biopha.2020.111003. Epub 2020 Nov 20. PMID: 33227702. https://www.sciencedirect.com/science/article/pii/S0753332220311951?via%3Dihub
Mizutani A, Endo A, Saito M, Hara T, Nakagawa M, Sakuraya K, Murano Y, Nishizaki N, Hirano D, Fujinaga S, Ohtomo Y, Shimizu T. Hydrogen-rich water reduced oxidative stress and renal fibrosis in rats with unilateral ureteral obstruction. Pediatr Res. 2022 Jun;91(7):1695-1702. doi: 10.1038/s41390-021-01648-7. Epub 2021 Aug 7. PMID: 34365467 https://www.nature.com/articles/s41390-021-01648-7
Case study:
Cisplatin-induced acute kidney injury: Same references as above.
